Определения химия 8 класс 1 четверть
Схема. Химические формулы в 8 классе
4. Основные определения в 8 классе
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Определения химия 8 класс 1 четверть
Цели урока : проверка знаний и умений учащихся, степени усвоения ими учебного материала.
Тип урока : урок развивающего контроля.
Оборудование : карточки с заданиями, справочные таблицы.
ХОД УРОКА
1. Организационный момент
Мотивация к учебной деятельности. Учитель сообщает тему урока, формулирует цели урока.
2. Выполнение контрольной работы
Контрольная работа по химии. Вариант 1
Контрольная работа по химии. Вариант 2
3. Рефлексия учебной деятельности
В конце урока учитель раздает на каждую парту краткую запись с ответами на контрольную работу.
Ответы на контрольную работу. Вариант 1
Ответы на контрольную работу. Вариант 2
4. Домашнее задание
Вы смотрели: Контрольная работа по химии в 8 классе с ответами (2 варианта). УМК Габриелян О.С. (Дрофа). Поурочное планирование по химии для 8 класса (Ястребова О.Н). Урок 12. Контрольная работа по теме «Атомы химических элементов» + ОТВЕТЫ.
Вернуться к Списку уроков Тематического планирования по химии в 8 классе.
Урок 2 Бесплатно Основы химии
Первоначальные химические понятия
Химики, как и любая другая группа учёных, между собой общаются на своём собственном химическом языке – они используют специальные термины, обозначающие различные понятия.
Химических терминов – тысячи. Важнейшие из них – атом, молекула, элемент, реакция, технология.
Все что нас окружает состоит из очень маленьких частей.
Современные учёные не останавливаются в поиске самой маленькой частицы, которую уже нельзя разделить на более мелкие.
В классической химии самой маленькой частицей является атом.
Атом – уникальное сочетание составляющих его частиц – протонов и нейтронов. В природе встречается 89 разных видов атомов. Современная наука даже научилась получать атомы искусственно, и таких «искусственных» атомов известно 27.
Химия – наука очень последовательная, в ней всё идёт друг за другом в строгом порядке. Каждый вид атомов называется химическим элементом.
Молекула – сочетание атомов одного или нескольких элементов.
Вещество – совокупность одинаковых молекул.
В настоящее время известно около 10 миллионов различных веществ.
Взаимодействие веществ между собой осуществляется в ходе химических реакций.
Поясним эту цепочку понятий на простом примере.
Например, атомы химического элемента углерода могут образовывать два простых вещества: графит и алмаз.
Атомы серы могут образовывать целых три простых вещества: ромбическую, моноклинную и пластическую серу (да, в придумывании названий химики не обладают особой фантазией).
Кстати, тот желтый порошок серы, который вы все привыкли видеть, – это ромбическая сера. Моноклинная сера образуется, если серу расплавить и медленно охлаждать. А если охладить резко (например, вылить расплавленную серу в холодную воду), то получается пластическая сера – коричневое вещество, похожее на резину.
А вот атомы углерода и серы друг с другом образуют вещество, совсем не похожее ни на одно из вышеописанных – сероуглерод. Это прозрачная жидкость желтоватого цвета, которая легко горит и очень ядовита, в отличие от углерода и серы по отдельности. Процесс соединения между собой углерода и серы и называется химической реакцией.
Пройти тест и получить оценку можно после входа или регистрации
Основы атомно-молекулярного учения
Химические знания развивались постепенно.
Для объяснения результатов экспериментов ученые создавали теории.
Теория – совокупность научных идей и положений, которая способна объяснять известные научные факты.
Когда новые экспериментальные данные вступают в противоречие с существующей теорией – становится ясно, что эта теория ошибочна.
Возникает необходимость создания новой теории, и это повторяется постоянно. И каждая теория вносит свой вклад в развитие химического знания. На схеме мы постарались изложить ключевые периоды в развитии химических теорий.
Теория флогистона, конец 1690-1710-е годы
Считалось, что при нагревании вещества выделяют флогистон, обладающий отрицательной массой, и поэтому масса веществ при нагревании увеличивается.
Кислородная теория горения, 1750-е годы
Химик Антуан Лавуазье открыл кислород и обнаружил, что при нагревании вещества соединяются с кислородом, поэтому их масса растёт.
Атомно-молекулярное учение, 1900-е годы
Все вещества состоят из молекул, молекулы из атомов, у каждого из которых строго определённое количество электронов
Теория электронного строения вещества, современность
Выяснено, что электроны в составе веществ не принадлежат конкретным атомам, а способны перемещаться по всему объёму вещества. Благодаря этому их свойству при определённых условиях возникает электрический ток.
В настоящее время общепринятной является последняя на представленной схеме теория.
Атом – мельчайшая частица химического элемента – состоит из протонов, нейтронов и электронов.
Протоны и нейтроны упакованы очень плотно и образуют ядро, а вокруг ядра на очень большом расстоянии находятся электроны, которые часто перемещаются между атомами хаотично, но при этом общее соотношение электронов и протонов не меняется.
На самом деле расстояние между ядром и электронами огромно.
Если представить ядро атома размером с апельсин, то электроны будут находиться от него в полутора-двух метрах. Так что все мы, по сути, состоим из пустоты!
А ещё каких-нибудь сто лет назад была принята «булочная» теория строения атома: атом представляли, как булку с изюмом, в которой в качестве изюминок подразумевали электроны.
Пройти тест и получить оценку можно после входа или регистрации
Химия 8 класс. Все формулы и определения
«Химия 8 класс. Все формулы и определения»
Ключевые слова: Химия 8 класс. Все формулы и определения, условные обозначения физических величин, единицы измерения, приставки для обозначения единиц измерения, соотношения между единицами, химические формулы, основные определения, кратко, таблицы, схемы.
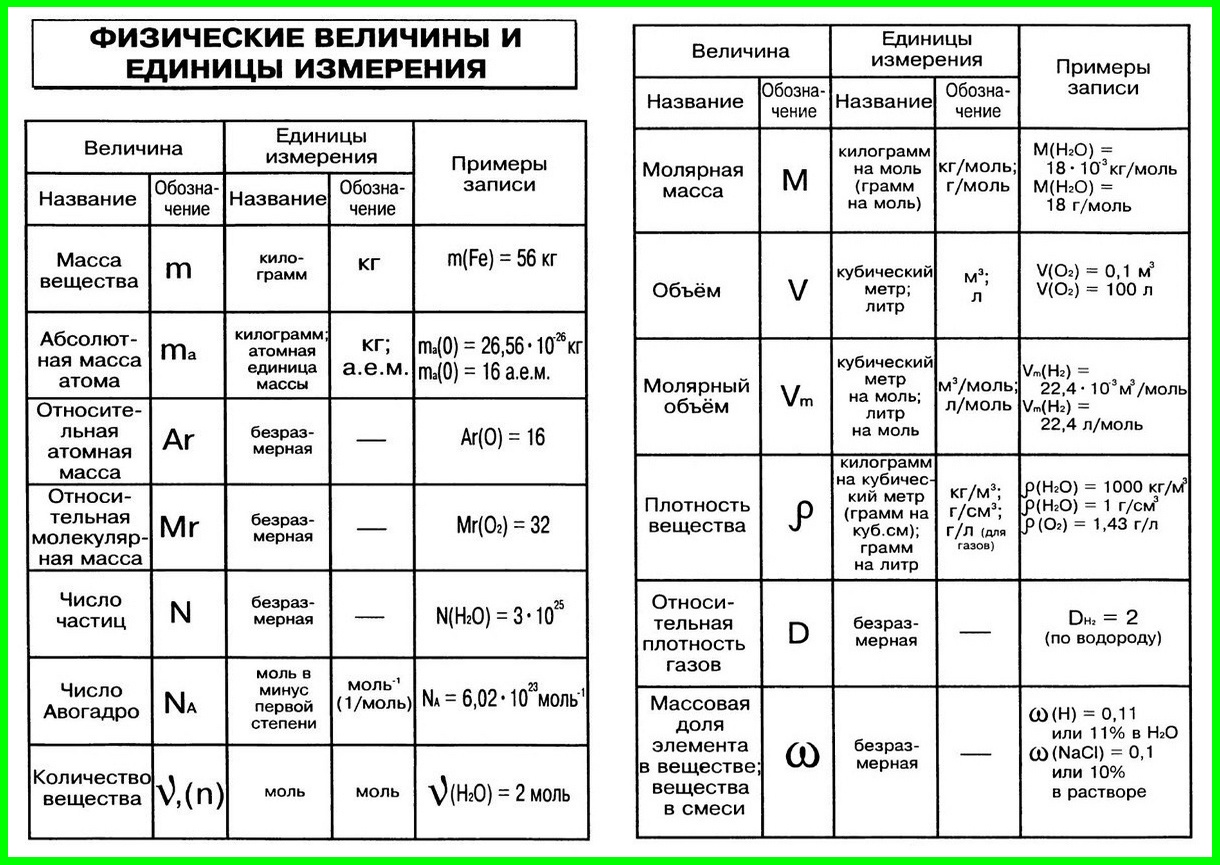
1. Условные обозначения, названия и единицы измерения
некоторых физических величин, используемых в химии
2. Соотношения между единицами физических величин
3. Химические формулы в 8 классе
4. Основные определения в 8 классе
АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
1. Существуют вещества с молекулярным и немолекулярным строением.
2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры.
3. Молекулы находятся в непрерывном движении.
4. Молекулы состоят из атомов.
6. Атомы характеризуются определённой массой и размерами.
При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются. Атомы при химических явлениях перегруппировываются, образуя молекулы новых веществ.
ЗАКОН ПОСТОЯНСТВА СОСТАВА ВЕЩЕСТВА
Каждое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный качественный и количественный состав.
ВАЛЕНТНОСТЬ
Валентность — свойство атома химического элемента присоединять или замещать определённое число атомов другого элемента.
ХИМИЧЕСКАЯ РЕАКЦИЯ
Химическая реакция — явление, в результате которого из одних веществ образуются другие. Реагенты — вещества, вступающие в химическую реакцию. Продукты реакции — вещества, образующиеся в результате реакции.
Признаки химических реакций:
1. Выделение теплоты (света).
2. Изменение окраски.
3. Появление запаха.
4. Образование осадка.
5. Выделение газа.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка.
Презентация была опубликована 7 лет назад пользователемЛев Урюпин
Похожие презентации
Презентация на тему: » ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 1 полугодие 8 класс Л.И.Настина, учитель химии.» — Транскрипт:
1 ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ 1 полугодие 8 класс Л.И.Настина, учитель химии
4 Вещества – это то, из чего состоят тела
5 Химический элемент металл неметалл Химический элемент Химический элемент – определенный вид атома.
6 План характеристики элемента: 1. Символ и название. 2. Положение в ПСХЭ. 3. Строение атома. 4. Электронная конфигурация. 5. Структурная конфигурация. 6. Формула и характер высшего оксида. 7. Формула гидроксид него соединения.
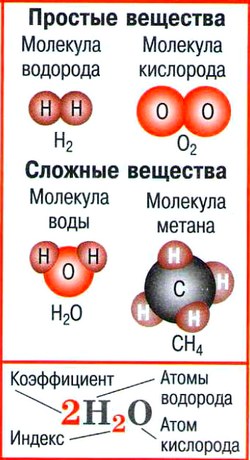
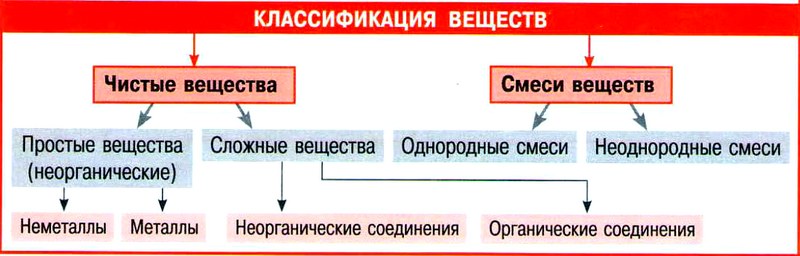
8 это вещества, состоящие из атомов одного химического элемента это вещества, состоящие из атомов двух или нескольких химических элементов Вещества Простые Сложные HH Cu H Cl
9 Сложные вещества- химические соединения Химический элемент Свободные атомы Простые вещества Сложные вещества
10 Нагревание вольфрамовой нити в лампочке Таяние мороженого Проволока сплющивается от удара молотком Дробление сахара Сгибание гвоздя Испарение воды
11 Задание. Найти рисунок, не относящийся к химическим явлениям. 1. Смесь бертолетовой соли и фосфора взрывается от удара молотком 2. Реакция хамелеона 3. Листопад 4. Протухание яйца 5. Ржавление гвоздя 6. Горение костра
12 Признаки химической реакции 1. Изменение окраски. 2. Выделение или поглощение теплоты. 3. Появление запаха. 4. Образования осадка. 5. Выделение газа.
13 ПЕРИОДИЧНОСТЬ СВОЙСТВ в ПЕРИОДАХ: В пределах одного периода слева направо металлические свойства ослабевают; А неметаллические возрастают. ПОТОМУ ЧТО: 1. Растет число электронов на внешнем уровне; 2. Радиус атома уменьшается; 3. Число энергетических уровней постоянно. ПЕРИОДИЧНОСТЬ СВОЙСТВ В ГЛАВНЫХ ПОДРУППАХ: В пределах одной и той же группы сверху вниз металлические свойства усиливаются; А неметаллические уменьшаются. ПОТОМУ ЧТО: 1. Число электронов на внешнем уровне одинаково; 2. Радиус атома увеличивается; 3. Число энергетических уровней в атомах растет.
14 Под ВАЛЕНТНОСТЬ (сила) понимают свойства атомов образовывать химические связи с другими атомами, а также число одинарных связей. Валентность у элементов бывает: постоянная, переменная. Определять валентность можно также с помощью ПСХЭ.
15 Химические формулы Химическая формула – это условная запись состава вещества посредством химических знаков и индексов.
17 Закон постоянства состава вещества или закон Пруста. каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав. каждое химически чистое вещество с молекулярным строением независимо от места нахождения и способа получения имеет один и тот же постоянный качественный и количественный состав.
18 Индекс показывает количество атомов данного элемента в молекуле.показывает количество атомов данного элемента в молекуле. Итак, состав веществ выражается химическими формулами с целочисленными индексами, например Н 2 О, НСl, СН 4, HNO 3, CuS, Na 3 PO 4, P 2 O 5, Na 2 SO 4HNO
19 Типы химической связи
23 Русское название Произношение Металлы Na K Ca Ba Cu Ag Au Zn Pb Hg Al Mg Mn Fe натрий железо феррум свинец плюмбум цинк барий ртуть гидраргирум алюминий калий серебро аргентум марганец медь купрум кальций золото аурум магний
24 Русское название Произношение Неметаллы S Cl Br C Si J N P O F H cерауглеродводородкремний кислород фосфор бром хлор фтор йод азот бром йод хлор фтор эсэнашо цепи силициум
26 Массовые доли элементов. ФОРМУЛА: Ar (эл.) n W (эл.) W (эл.) Mr (в-ва) Mr (в-ва) Единицы измерения [доли] или [%], в этом случае умножаем на 100 %.
28 ОСНОВНЫЕ ПОЛОЖЕНИЯ ПЛАНЕТАРНОЙ МОДЕЛИ : Атом – это микрочастица, которая имеет форму шара. Атом – это сложная система, состоящая из ядра и электронов. Ядра находятся в центре атома и имеют очень маленький размер. Ядро имеет положительный заряд, величина которого определяется числом протонов в нем. Электроны движутся вокруг ядра, имеют ничтожно малую массу и размеры, обладают отрицательным зарядом. Атом электронейтрален, поэтому число протонов и электронов в нем одинаково.
29 Как измерить вещество? Необходимо точно знать число частиц вещества, т.е. его количество Единица количества вещества – 1 моль, т.е частиц
33 Для расчёта количества n= m / М n=V/V m n =N / N a
34 Но если число частиц известно? В 1 моле содержится частиц Эта величина называется число Авогадро n =N / N a
35 Амедео Авогадро высказал предположение в 1811 году, что В равных объемах различных газов при одинаковых условиях (температура, давление) содержится одинаковое число молекул.
36 Молярный объем газа Vm величина, определяемая отношением объема данной порции газа V к химическому количеству вещества n в этой порции величина, определяемая отношением объема данной порции газа V к химическому количеству вещества n в этой порции: Нормальные условия: температура 0°С давление 101,325 к Па
38 Производные формулы Иванова Г.А. m= n М V=n V m N =n N a
39 массовой долей Отношение массы растворимого вещества к общей массе раствора называют массовой долей растворенного вещества. Массовую долю обозначают греческой буквой W (омега) и выражают в долях единицы или процентах.
40 Оцените своё состояние после урок Мне хорошо Как всегда унылое Я много знаю Я плохо понял и умею